FOPI.flash April 2024
In dieser Ausgabe
- Editorial: Licht und Schatten
- Innovationsbilanz: Über 400 innovative Arzneimittel in den letzten 10 Jahren
- Zahl des Monats: 295 klinische Studien
- Podcast: EU-HTA – welchen Nutzen bringt die Nutzenbewertung?
- Interview Rebecca Fowler: Datennutzung bringt Patient:innen erhebliche Vorteile

Editorial
Licht und Schatten
Jedes Jahr ziehen wir gemeinsam mit der Medizinmarktaufsicht der AGES Bilanz über die Arzneimittel-Innovationen, also der Medikamente mit neuem Wirkstoff. 2023 wurden 36 Innovationen von der AGES verzeichnet, womit die Summe der Innovationen in den letzten zehn Jahren die 400er-Marke übersprungen hat. Das ist eine gute Nachricht für das österreichische Gesundheitssystem. Diese Therapien stellen oftmals einen Durchbruch für Ärzt:innen und Patient:innen dar und eröffnen neue Behandlungswege. Der Wert für die Betroffenen und in größerem Zusammenhang auch für die Volksgesundheit ist nicht zu unterschätzen. Wenn auf lange Sicht zum Beispiel 20 Prozent weniger Todesfälle bei Herz-Kreislauf-Erkrankungen erzielt werden können, wie nachweislich für den Zeitraum zwischen 2000 und 2022 belegbar ist, oder wenn neue Impfungen zugelassen werden konnten, dann ist das ein substanzieller Benefit für die einzelnen Menschen und für die Gesellschaft. (Mehr zu den Arzneimittel-Innovationen gleich im ersten Beitrag.)
So positiv die Zulassung dieser Medikamente ist, so wichtig ist es aber auch, den Zugang zu den Innovationen rasch und bundesweit einheitlich sicherzustellen. Dazu braucht es einen effizienten und unbürokratischen Prozess, der sich für uns aktuell noch nicht klar abzeichnet. Beim geplanten Bewertungsboard sehen wir vielmehr einige Punkte, an die wir konkrete Bedenken knüpfen: Bei der angedachten Zusammensetzung des Boards ist die fachmedizinische Expertise unterrepräsentiert. Weiters könnte es durch den Evaluierungsprozess mit mindestens fünf Monate Verfahrensdauer zu Verzögerungen und/oder Beschränkungen des Patient:innenzugangs zu hochspezialisierten Therapien kommen. Auch besteht das Risiko der Krankheitsverschleppung durch Einschränkung des (fach-)ärztlichen Handlungsspielraums in Bezug auf die Behandlungsoptionen. Kritisch sehen wir außerdem, dass keine klare methodologische Trennung zwischen Medizin und Ökonomie vorgesehen ist. Und nicht zuletzt könnte die Ausgestaltung des Bewertungsboards auch Österreich als Standort für medizinische Forschung aufgrund mangelnder Planungssicherheit gefährden.
Nach vielen Gesprächen mit betroffenen Ärzt:innen und Patient:innen appellieren wir deshalb an die Verantwortlichen, dass diese Aspekte bei der weiteren Ausgestaltung des Gremiums und seiner Arbeitsweise berücksichtigt werden.
Julia Guizani, Amaya Echevarria und Leif Moll
Präsidium des Forums der forschenden pharmazeutischen Industrie in Österreich (FOPI)

Bilanz
Über 400 innovative Arzneimittel in den letzten 10 Jahren
Innovative Therapien oder Arzneimittel zur Prävention wie die erstmals zugelassenen RSV-Impfungen stellen oftmals einen Durchbruch dar und eröffnen Ärzt:innen sowie Patient:innen neue Behandlungsoptionen. Nicht selten sind daran große Hoffnungen geknüpft, die durch intensive Forschung und Entwicklung möglich werden. Über 42 Milliarden Euro investiert die europäische Pharmaindustrie pro Jahr in diese Forschung. Das trägt dazu bei, dass 2023 insgesamt 36 Arzneimittel mit einem komplett neuen Wirkstoff zugelassen werden konnten. Über die letzten zehn Jahre betrachtet, kamen über 400 innovative Pharmazeutika in Österreich auf den Markt. Ein Bericht der Medizinmarktaufsicht der Österreichischen Agentur für Gesundheit und Ernährungssicherheit (AGES) und des Forums der forschenden pharmazeutischen Industrie in Österreich (FOPI).
Mit einer Forschungs- und Entwicklungsquote von 12,4 Prozent vom Umsatz ist die europäische Pharmaindustrie die mit Abstand forschungsintensivste Branche aller Technologiesektoren – deutlich vor der IT, der Auto- oder der Luftfahrtindustrie. Ergebnis der fokussierten Arbeit sind über 400 Arzneimittel mit einem neuen Wirkstoff, die in den letzten zehn Jahren zugelassen werden konnten. Im letzten Jahr kamen 36 innovative Medikamente auf den Markt.
„Jede einzelne dieser neuen zugelassenen Therapien wurde von den europäischen Arzneimittelbehörden gemeinsam sorgfältig auf Qualität, Sicherheit und Wirksamkeit überprüft“, erklärt DI Dr. Günter Waxenecker, Leiter des Geschäftsfelds Medizinmarktaufsicht in der AGES. „Die Zahl der Innovationen liegt – nach dem postpandemischen ‚Ausreißer-Jahr‘ 2022 – wieder im langjährigen Schnitt. Sie zeigt aber auch, dass Arzneimittelforschung kein ‚Selbstläufer‘ ist. Zahlreiche Projekte scheitern im Lauf des langen Entwicklungs- und Forschungsprozesses bis zur Zulassung, manche sogar erst im späten Stadium einer klinischen Studie. Umso bedeutsamer sind daher all jene Therapien, die den langwierigen – aber im Sinne der Sicherheit der Patienten notwendigen – Prozess meistern, die Zulassung schaffen und als Innovationen den Patient:innen zur Verfügung stehen.“
Starker Fokus auf Onkologie
Von den 36 zugelassenen Therapien mit einem neuen Wirkstoff im Jahr 2023 entfällt nach wie vor der größte Teil, ein Drittel, auf Krebsmedikamente. 17 Prozent sind immunmodulierende Arzneimittel, die entweder gezielt das Immunsystem dämpfen, um etwa Autoimmunerkrankungen wie Schuppenflechte oder Multiple Sklerose zu behandeln, oder ebenso methodisch das Immunsystem stimulieren. 14 Prozent stellen Therapien für seltene Erkrankungen bei Kindern, 8 Prozent sind Impfstoffe. Und zusätzlich kam eine Vielzahl an Innovationen für verschiedene andere Therapiegebiete wie zum Beispiel Migräne, chronischen Husten oder Herz-Kreislauf-Erkrankungen auf den Markt.
RSV-Impfstoffe und andere Beispiele
Als herausragende Beispiele nennt AGES Medizinmarktaufsicht-Geschäftsfeldleiter Waxenecker:
- RSV-Impfstoffe
Das Respiratory Syncytial Virus (RSV) ist eine mittlerweile bekannte Ursache für akute Infektionen der unteren Atemwege, insbesondere bei kleinen Kindern und älteren Erwachsenen. Erstmals wurden nun zwei Impfstoffe zur Prävention für Erwachsene ab 60 Jahren zugelassen. Aufgrund der Gefährlichkeit und hohen Anzahl an Todesfällen ist die Impfung gegen RSV im österreichischen Impfplan für Erwachsene ab 60 Jahren empfohlen. Der erste der beiden Impfstoffe ist auch für Schwangere verfügbar und bietet somit für Risiko-Säuglinge – mittels Impfung der Mutter – eine passive Präventionsmöglichkeit („Nestschutz“). - BITE-bispezifischer Antikörper/T-Cell-Engager
Vier dieser neuen Wirkstoffe wurden 2023 zugelassen. Sie binden als bispezifischer Antikörper mit zwei verschiedenen Bindungsstellen einerseits an die krankmachenden Zellen, andererseits an jene Immunzellen, die die Krankheit bekämpfen. Diese Verbindung aktiviert damit sehr effizient das körpereigene Immunsystem gegen die jeweilige Krankheit. - Mavacamten
In der Kardiologie gibt es erstmals einen zugelassenen Wirkstoff aus der Gruppe der sogenannten Myosin-Inhibitoren, der eine spezifische medikamentöse Behandlung einer verbreiteten Form der schweren Herzschwäche, der hypertrophen Kardiomyopathie, ermöglicht. - Etranacogen dezaparvovec
Für Bluter:innen gibt es seit 2023 (nach der ersten Gentherapie zur Behandlung schwerer Hämophilie A im Jahr 2022) nun auch eine Gentherapie für die zweithäufigste Form der Bluterkrankheit, der Hämophilie B. Somit sind erstmals beide der häufigsten Hämophilie-Erkrankungen gen-therapeutisch abgedeckt. - Kontinuierliche Fortschritte für mehr Anwendungsfreundlichkeit
In der Onkologie gibt es erstmals einen neuen Wirkstoff (Cedazuridin) der es ermöglicht, dass statt der bisher notwendigen und belastenden intravenösen Decitabin-Chemotherapie-Anwendung auch deren orale Anwendung für Krebspatient:innen möglich wird.
In der Infektiologie gibt es erstmals auch einen nur mehr wöchentlich (statt wie bisher täglich) zu verabreichenden, wirksamen Vertreter der Substanzklasse der Echinocandine, der gegen die invasive Candidose, eine schwere, lebensbedrohliche Pilz-Infektion in der Blutbahn, wirkt. Neben dem zeitlichen Aufwand, der mit Zubereitung, Konstituierung und Verabreichung von Infusionen in Spitälern einhergeht und dadurch nun deutlich vereinfacht und reduziert wird, profitieren insbesondere die Patient:innen durch die weniger verabreichungsbelastende Therapie.
Arzneimittel-Innovationen für Ärzt:innen als Prävention unverzichtbar
Aus ärztlicher Sicht unterstreicht Prim. Doz. Dr. Arschang Valipour, Direktor des Karl-Landsteiner-Instituts für Lungenforschung, Klinik Floridsdorf, Wien, die Relevanz der neuen RSV-Impfstoffe als Innovationen: „Spätestens seit der COVID-19 Pandemie wissen wir um die klinischen Auswirkungen von hochinfektiösen Atemwegserkrankungen Bescheid. Eine RSV-Infektion bei erwachsenen Risikogruppen ist mindestens genauso bedrohlich wie Influenza oder SARS-CoV-2, mit gesundheitsökonomischen Folgen, erhöhter Morbidität und Mortalität. Umso bedeutsamer, dass nun eine RSV-Impfung für den klinischen Einsatz im Sinne einer klinisch wirksamen Prävention zur Verfügung steht.“
Mehr über die Zahl der klinischen Studien im Jahr 2023 und die Rolle der AGES im europäischen Zulassungsprozess sind auf der Website des FOPI hier nachzulesen.
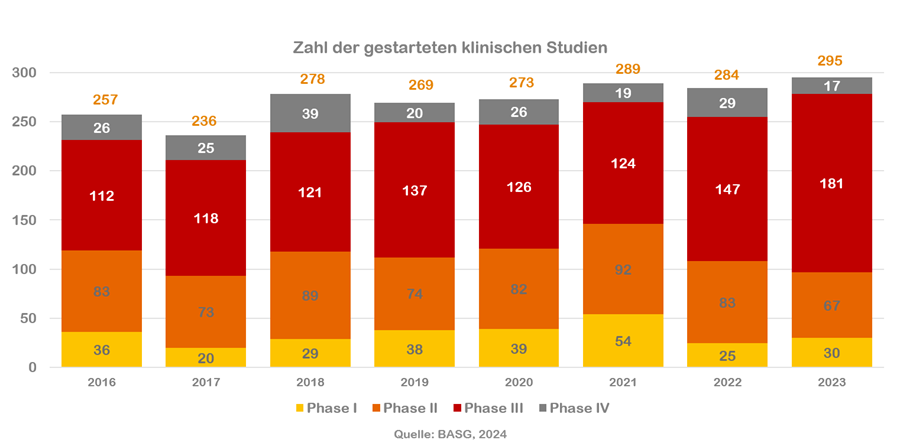
Zahl des Monats
295
klinische Studien wurden im Jahr 2023 in Österreich gestartet. Damit liegt die Zahl der Studien leicht über dem Niveau der Vorjahre. Expert:innen befürchten dennoch, dass Österreich seinen Ruf als flexibles, rasch agierendes Land verlieren könnte. Alle Verantwortlichen im Gesundheitssystem, von der Politik über die Behörden und Universitäten bis hin zu den Unternehmen, sollten deshalb alles daransetzen, die Rahmenbedingungen für klinische Forschung zu verbessern.

Podcast
Am Mikro|skop: EU-HTA – welchen Nutzen bringt die Nutzenbewertung?
Ab 2025 sollen die bislang nationalen Nutzenbewertungen von neuen Arzneimitteln europaweit harmonisiert ablaufen. Bis dahin müssen die Prozesse ausgestaltet sein: Doch viele Expert:innen sehen bei den bisherigen Plänen der EU-Kommission „Luft nach oben“. Dabei ist das Thema nicht nur etwas für Fachleute. Schließlich geht es darum, den Zugang zu neuen Therapien für die Patient:innen zu verbessern. Deshalb fragt Moderatorin Martina Rupp in der 27. Folge von „Am Mikro|skop“ die Leiterin des AIHTA Claudia Wild, wie diese Nutzenbewertung künftig ablaufen wird und was sie fürs heimische Gesundheitswesen bringt. Sie diskutiert die Chancen und Risken aber auch mit Kerstin Schorn von Takeda, die die Perspektive der forschenden Pharmaindustrie einbringt und auf große Herausforderungen hinweist.
Diese und alle anderen Episoden des – gemeinsam mit dem Fachverband der Chemischen Industrie Österreichs (FCIO) und Chemiereport/Austrian Life Sciences produzierten – Podcasts finden Sie hier: www.chemiereport.at/am-mikroskop
Diese Folge wird von Takeda gesponsert.

Im Gespräch
Rebecca Fowler: Datennutzung bringt Patient:innen erhebliche Vorteile
Europa kämpft immer noch mit viel zu viel Bürokratie und Problemen bei der Datennutzung, meint Rebecca Fowler, die erst im März 2024 neu bestellte Geschäftsführerin von Takeda Österreich. Sie hat noch einen frischen Blick auf das europäische Umfeld sowie das heimische Gesundheitssystem und ortet darin Hindernisse für den schnellen Zugang zu Innovationen. Wo man ansetzen müsste und welche Rahmenbedingungen aus ihrer Sicht Unternehmen für Forschung & Produktion in Österreich brauchen, verrät sie im Interview mit FOPI.flash.
Sie sind erst seit März 2024 als neue Geschäftsführerin von Takeda in Österreich. Dennoch haben Sie sich rasch für die Interessensvertretung der Branche engagiert. Was motiviert Sie, gemeinsam mit anderen die Stimme zu erheben?
Wie bei allen meinen vorherigen Positionen möchte ich immer an Standorte und Jobs wechseln, bei denen ich denke, dass ich für Patient:innen und das Gesundheitssystem wirklich etwas verändern kann. Dazu ist es wichtig, mit allen Beteiligten im Gesundheitswesen in den Dialog zu treten und es geht zunächst darum, zuzuhören und zu verstehen, wo konkrete Herausforderungen oder konkrete Hürden in der Versorgung liegen. Deshalb suche ich aktiv den Dialog innerhalb des Branchenverbandes
Sie waren zuletzt in Singapur als Teil des Takeda Emerging Markets Team tätig. Wie nehmen Sie das europäische und im Besonderen das österreichische Gesundheitssystem wahr?
In meinen 25 Jahren in der Pharmaindustrie habe ich tiefe Einblicke in die Gesundheitssysteme in Großbritannien, Asien und der Schweiz gewonnen. Europa ist in vielerlei Hinsicht in einer besseren Position als viele andere Regionen und macht weiterhin große Fortschritte in Richtung einer besseren Gesundheitsversorgung für alle. Es sind jedoch noch Herausforderungen zu bewältigen. Europa kämpft immer noch mit zu viel Bürokratie und Problemen bei der Datennutzung, beides ist auch im österreichischen Gesundheitssystem sichtbar und führt weiterhin zu Hindernissen für den schnellen Zugang zu Innovationen, z.B. für seltene und komplexe Erkrankungen.
Wo sehen Sie also die größten Schwächen?
Ich sehe zwei Themen, denen wir in Europa mehr Aufmerksamkeit schenken sollten. Erstens ein schnellerer und gleichberechtigter Zugang zu innovativen Therapien, um österreichische Patient:innen besser zu versorgen und sicherzustellen, dass modernste Behandlungen diejenigen erreichen, die sie benötigen, was zu besseren Gesundheitsergebnissen führen kann. Zweitens müssen wir im Bereich von Datennutzung und KI-Technologien erhebliche Fortschritte machen. Dies kann den Patient:innen viele Vorteile bieten, darunter eine bessere, schnellere Diagnose und personalisierte Therapien, es kann aber auch dem gesamten Gesundheitssystem Benefits bringen durch ein gezielteres und damit effizienteres Vorgehen.
Österreich ist für Takeda ein strategisch wichtiger Standort. Aber Takeda ist als eines der großen produzierenden Pharmaunternehmen auch umgekehrt für Österreich von Bedeutung. Wie stehen Sie zum Thema „Reshoring“, also dem Zurückholen der Arzneimittel-Produktion nach Europa?
Takeda verfügt über Produktionsstandorte auf der ganzen Welt. Als globale Organisation ist es wichtig, dass wir über ein breites Netzwerk aus Forschung, Entwicklung und Produktion verfügen, um sicherzustellen, dass wir die Bedürfnisse unserer Patient:innen auf der ganzen Welt erfüllen können. Österreich spielt für Takeda eine sehr wichtige Rolle, sowohl in der Produktion als auch in anderen Geschäftsbereichen wie Forschung & Entwicklung und Global Pathogen Safety. Österreich bietet für die Pharmaindustrie viele Vorteile, beispielsweise einen großen Talentepool und ein stabiles wirtschaftliches Umfeld. Takeda setzt sich stark für die Weiterentwicklung in Europa und Österreich ein. Erst im letzten Jahr erfolgte der Spatenstich für eine neue dreistellige Investition in ein biopharmazeutisches Forschungs- und Entwicklungslabor in der Seestadt in Wien.
Welche Rahmenbedingungen brauchen Pharmaunternehmen in Europa, um in Europa zu forschen sowie zu fertigen?
Der Bau des neuen Takeda Forschungs- und Entwicklungslabor in der Wiener Seestadt zeigt deutlich, dass wir an diesen Standort glauben und weiter investieren. Unsere Branche braucht weiterhin eine enge Zusammenarbeit mit wichtigen Interessengruppen und eine offene Diskussion zu Themen wie Finanzierung und Investitionen, regulatorisches Umfeld, Infrastruktur und qualifizierte Arbeitskräfte. Um auch weiterhin ein attraktives Umfeld zu schaffen, brauchen wir starke politische Unterstützung sowie klare und zeitnahe Verwaltungsentscheidungen.
Über Takeda Österreich:
In Österreich findet bei Takeda jeder Prozessschritt für innovative Arzneimittel statt: von der Forschung & Entwicklung, über Plasmaaufbringung und Produktion bis zur Versorgung der Patient*innen. Rund 4.500 Mitarbeiter*innen tragen dazu bei, dass Medikamente aus Österreich in über 100 Länder weltweit gelangen und Patient*innen in Österreich Zugang zu den innovativen Arzneimitteln von Takeda erhalten. Das österreichische Produktportfolio hilft Patient*innen unter anderem in den Bereichen Onkologie, seltene metabolische Erkrankungen, Gastroenterologie und Immunologie. Takeda wurde als zertifizierter Top Employer auch für seine herausragende Employee Experience und sein Engagement für Inklusion ausgezeichnet und ist Vorreiter im Bereich der nachhaltigen und verantwortungsvollen Arzneimittelproduktion. https://www.takeda.at

