FOPI.flash September 2022
In dieser Ausgabe
- Editorial: Spiel mit falschen Karten
- Interview Alice Roznowiez zum französischen Health Innovation Plan: ein ermutigendes Signal
- Zahl des Monats: 70 neue Medikamente
- Podcast: Könnte es eng werden?
- Wordrap Eike Wüstenberg: Arbeitsaufwand für Studienärzt:innen steigt
- Kampagne: Wir sagen danke.

Editorial
Spiel mit falschen Karten
Wie das Amen im Gebet kommen von der Sozialversicherung in regelmäßigen Abständen Informationen über steigende Arzneimittelpreise – meist verbunden mit der Forderung, die rasant gewachsenen Gesundheitskosten über Zuzahlungen der Pharmaindustrie zu refinanzieren. Allein: Die Darstellungen stimmen so nicht. Die Sozialversicherung kommuniziert gezielt und beharrlich Zahlen zur Entwicklung der Arzneimittelkosten, die ein verzerrtes Bild vermitteln. Ganz bewusst werden die Erträge aus Preismodellen, die mindestens im dreistelligen Millionenbereich liegen, nicht berücksichtigt. So werden die Steigerungsraten der Arzneimittelkosten als wesentlich höher dargestellt, als sie tatsächlich sind.
Das ist ein Spiel mit falschen Karten und für sich genommen ärgerlich. Noch wichtiger aber ist: Es bedient eine falsch gelenkte Diskussion.
Während die Preise bei allen Gütern des täglichen Lebens steigen und vor allem bei Hightech-Waren ohne Wimpernzucken hingenommen werden, müssen Produkte, die unserer Gesundheit dienen, laufend billiger werden.
Wieso ist das so?
Wieso diskutieren wir nicht, was uns Gesundheit wert sein darf? Die Bedeutung der Gesundheit hat uns die Pandemie in den letzten beiden Jahren doch deutlich vor Augen geführt. Wir sollten uns ein Beispiel an Frankreich nehmen, meinen wir, wo die Regierung unter Emmanuel Macron 7,5 Mrd. Euro investiert, um das Land im Rahmen des „Health Innovation Plan 2030“ zum europäischen Leader bei Innovationen im Gesundheitsbereich zu machen. Lesen Sie dazu das Interview mit Alice Roznowiez vom französischen Verband der forschenden Pharmaunternehmen und lassen Sie uns darüber reden, wie wir die Diskussion in Österreich ebenfalls in diese Richtung drehen können!
Bernhard Ecker, Anthea Cherednichenko und Michael Kreppel-Friedbichler
Präsidium des Forums der forschenden pharmazeutischen Industrie in Österreich (FOPI)

© Pexels
Im Interview
Alice Roznowiez zum französischen Health Innovation Plan: ein ermutigendes Signal
Unter dem Titel „Health Innovation Plan 2030“ will Emmanuel Macron 7,5 Milliarden Euro aufbringen und Frankreich zum europäischen Leader bei Innovationen im Gesundheitsbereich machen. Wie beurteilen Insider dieses Vorhaben – konkret die Vertreter:innen der französischen forschenden Pharmaindustrie? Ein Interview mit Alice Roznowiez von Leem, Les Entreprises du médicament (aus dem Französischen übersetzt).
Frau Roznowiez, was genau umfasst der Plan?
Der von Emmanuel Macron für 2021 angekündigte Plan Innovation Santé sieht eine Politik vor, die folgende Aspekte umfasst: Forschungsstandorte rund um Exzellenzzentren und Biocluster, neue Finanzmittel für klare Forschungsprioritäten, Stärkung der Fähigkeit Frankreichs, Talente anzuziehen und zu halten, hohe Priorität für die Attraktivität und Entwicklung der klinischen Forschung, Einrichtung einer Innovationsagentur sowie Maßnahmen für den Patientenzugang zu Innovationen. Der Staatschef betont insbesondere eine Strategie zur Beschleunigung in den vorrangigen Bereichen Biotherapien, digitale Gesundheit und Infektionskrankheiten. Ziel ist es, ab 2030 20 Biomedikamente gegen Krebs, neu auftretende Krankheiten sowie chronische Krankheiten in Frankreich zu produzieren.
Wie beurteilen Sie von Seiten der Pharmaindustrie den Plan? Was ist gut oder sogar richtungsweisend daran?
Insgesamt ist der Plan für uns ein ermutigendes Signal, das den strategischen Charakter der Pharmaindustrie bestätigt. Der Plan spiegelt ein begrüßenswertes Bewusstsein für die Notwendigkeit wider, gleichzeitig die Reindustrialisierung und die Unterstützung von Innovationen voranzutreiben, um die Attraktivität und Wettbewerbsfähigkeit in Frankreich wiederherzustellen. Die angekündigten Maßnahmen werden in erster Linie den Patient:innen zugutekommen. So gibt es beispielsweise zwei wichtige Fortschritte für den schnellen und gleichberechtigten Zugang der Patient:innen zu innovativen Behandlungen: Einerseits werden die Zugangsmechanismus tiefgreifend umgestaltet, womit es Frankreich möglich wird, seine Fristen zu verkürzen und sich damit den leistungsstärksten Ländern Europas anzunähern. Andererseits werden die Kriterien für die Aufnahme von Arzneimitteln in die sogenannte „liste en sus“ erweitert. Innerhalb der Gesundheitseinrichtungen ermöglicht diese Liste die Kostenübernahme für pharmazeutische Spezialitäten für bestimmte therapeutische Indikationen durch die Krankenversicherung zusätzlich zu den Krankenhaustarifen, wenn diese Indikationen einen innovativen Charakter aufweisen.
Was kommt zu kurz?
Die Maßnahmen des Plans stimmen mit mehreren Vorschlägen von Leem überein, die darauf abzielen, das Forschungsökosystem in Frankreich grundlegend umzugestalten. Es geht darum, die Mechanismen zu reformieren, die den Patient:innen einen schnellstmöglichen Zugang zu Innovationen ermöglichen, und die Wettbewerbsfähigkeit und Attraktivität Frankreichs als Industriestandort wiederherzustellen. Alles hängt nun von der klaren und schnellen Umsetzung dieser Vorschläge ab. Wir werden insbesondere auf den Inhalt des Gesetzentwurfs zur Finanzierung der Sozialversicherung 2023 achten.
Welche Hürden könnte es bis zur Realisierung 2030 geben?
Es gibt zwei Voraussetzungen für den Erfolg dieses Plans: zum einen die Lösung der Budgetrechnung und zum anderen eine enge und partnerschaftliche Steuerung der Reformen. Der Umfang der angekündigten Veränderungen macht es notwendig, zusätzliche Mittel bereitzustellen und somit das Wachstum wieder anzukurbeln. Das Ausmaß der von der Regierung angekündigten Ambitionen erfordert darüber hinaus eine Steuerung der Reformen auf höchster staatlicher Ebene. Leem erwartet, als engagierter, konstruktiver und wachsamer Partner gesehen zu werden.
Wie steht es prinzipiell um den Zugang für Patient:innen zu innovativen Therapien in Frankreich?
Im Juli 2021 wurden zwei Dekrete zur Umsetzung einer tiefgreifenden Reform der abweichenden Mechanismen für die Kostenübernahme von Arzneimitteln veröffentlicht, die eine wichtige und komplexe Arbeit konkretisieren. Sie entsprechen einer starken Erwartung der Industrie und setzen eine Verpflichtung der Regierung um, die diese anlässlich der strategischen Beratung der Gesundheitsindustrie im Jahr 2018 eingegangen war. Konkret vereinheitlicht die Reform die Mechanismen für den abweichenden Zugang mit zwei sehr klaren Zugangs- und Kostenübernahmevorrichtungen: Ein „früher Zugang“, der darauf abzielt, innovative Arzneimittel für schwere, seltene oder zu Behinderungen führende Erkrankungen, die zukünftig in die klassische Kostenübernahme durch die Krankenversicherung aufgenommen werden sollen, vorzeitig und auf Antrag eines Herstellers zu übernehmen. Und ein „mitfühlender Zugang“, der darauf abzielt, Arzneimittel, die einem therapeutischen Bedarf bei schweren, seltenen oder zu Behinderungen führenden Erkrankungen entsprechen, auf Initiative eines Verschreibers oder der Behörden zu übernehmen, ohne dass sie notwendigerweise innovativ sein müssen. Diese Vereinfachung stärkt die in Europa einzigartigen Mechanismen für den frühzeitigen Zugang und dürfte den französischen Patient:innen einen gleichberechtigten Zugang zu innovativen Therapien ermöglichen.
Ein Jahr später fällt die erste Bilanz positiv aus. Der Ball liegt nun bei den Behörden bzgl. der Umsetzung des Gesetzes und seiner verschiedenen Dekrete und Verordnungen. Dabei sind die Ziele im Auge zu behalten, die die Grundlage für den Aufbau dieses neuen Systems für den frühzeitigen Zugang zu Innovationen bildeten: Vereinfachung, Lesbarkeit und Tragfähigkeit.
Frankreich geht damit einen konträren Weg zu Deutschland und Österreich, wo derzeit gerade ein Sparkurs eingeschlagen wird. Halten Sie das für sinnvoll? Wir können nicht von einer entgegengesetzten Richtung sprechen. Zwar hat sich der Schraubstock der Regulierung und der Preissenkungen in den letzten drei Jahren etwas gelockert, und wir haben sehr wichtige Reformen – insbesondere die des Zugangs – in der vorherigen Fünfjahresperiode von Emmanuel Macron (2017-2022) verzeichnet. Dennoch ist der Druck nach wie vor sehr stark. Das Nettobudget für Arzneimittel hat sich zwischen 2009 und 2019 nicht verändert und der Anteil der Arzneimittelausgaben am ONDAM (Anm. dem nationalen Ziel für die Ausgaben der Krankenversicherung) ist von 15 % auf 11 % gesunken …
Leem ist der Berufsverband der in Frankreich tätigen Unternehmen, die Humanarzneimittel herstellen. Leem zählt heute mehr als 260 Mitgliedsunternehmen, von denen 50 % Kleinst- und Mittelbetriebe sind. Auf nationaler Ebene beschäftigt der Sektor mehr als 100.000 Personen in über 150 Berufen und erzielt einen Umsatz von mehr als 62 Mrd. Euro (davon die Hälfte im Export).
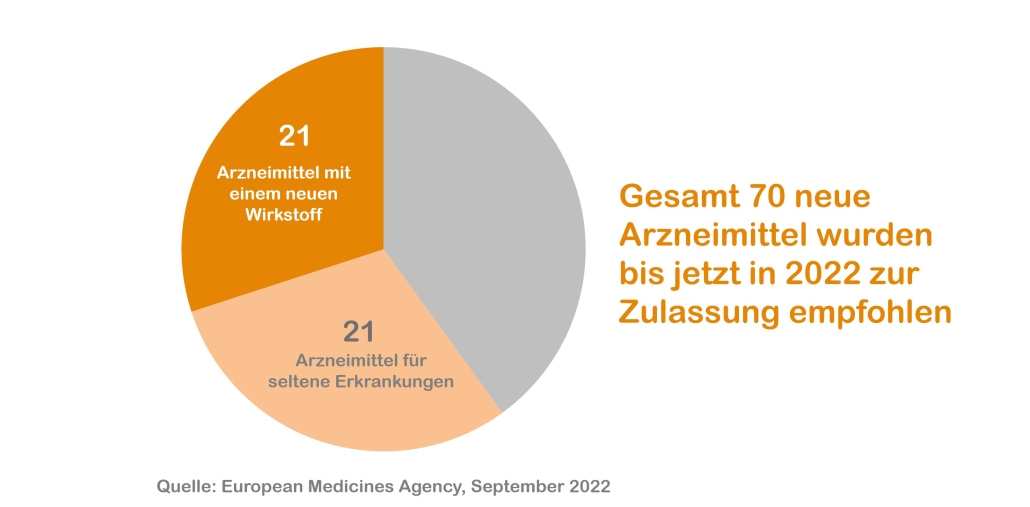
Zahl des Monats
70
neue Medikamente wurden allein im heurigen Jahr von der Europäischen Arzneimittelagentur EMA – konkret vom Committee for Medicinal Products for Human Use (CHMP) – für die Zulassung empfohlen. 21 davon sind Medikamente mit einem neuen Wirkstoff, 21 Arzneimittel für seltene Erkrankungen. Ein deutliches Zeichen für die ungebrochene Innovationskraft der forschenden Pharmaindustrie.
Quelle: European Medicines Agency, 16. September 2022

© accelent/Theo Hertenberger
Podcast
Am Mikro|skop – Könnte es eng werden?
Versorgungssicherheit in Krisenzeiten: Der Ukraine-Krieg und die daraus resultierende Energie-Krise lässt auch innerhalb der Pharmaindustrie die Alarmglocken schrillen. Wie sehr ist die Arzneimittelproduktion von steigenden Preisen und drohenden Engpässen betroffen? Ist die Herstellung im Ernstfall bedroht? Ist womöglich sogar die Versorgung der Patient*innen mit Medikamenten gefährdet? Und was müsste getan werden, um diese kritische Infrastruktur in jedem Fall aufrechtzuerhalten? Diese Fragen diskutiert Moderatorin Martina Rupp in der 14. Episode von Am Mikro|skop mit Ilse Bartenstein, Vorsitzende des Pharmaausschusses im Fachverband der Chemischen Industrie Österreichs (FCIO), und Karl Heinz Hofbauer, Leiter der Takeda Produktionsstätten in Wien. Diese und alle anderen Episoden des – gemeinsam mit dem Fachverband der Chemischen Industrie Österreichs (FCIO) und Chemiereport/Austrian Life Sciences produzierten – Podcasts finden Sie hier: www.chemiereport.at/am-mikroskop!

© ALK
Wordrap
Eike Wüstenberg: Arbeitsaufwand für Studienärzt:innen steigt
Eike Wüstenberg stuft österreichische Studienzentren (noch) als international anerkannt ein. Um das Renommee nicht aufs Spiel zu setzen, braucht es seiner Meinung nach Studienkoordinator:innen in den Zentren, weniger bürokratische Hürden und enge Timelines. Ein FOPI.Wordrap mit dem Vice President Medical Affairs von ALK Central Europe & International Markets.
Was fasziniert Sie an klinischer Forschung?
Klinische Forschung ist DER Motor für Fortschritt in der medizinischen Versorgung. Ohne sie könnten heute Millionen von Erkrankten nicht oder nur unzureichend behandelt werden. Damit bringt klinische Forschung am Ende allen Österreicher:innen etwas – als Patient:in, als Angehöriger und als Gesellschaft!
Was heißt klinische Forschung in Österreich für Sie?
Österreichische Studienzentren sind international renommiert. Ein Plus sind die ausgezeichnete Datenqualität sowie das hohe Engagement von Studienärzt:innen. Negativ sind Hürden in Bürokratie und bei der Patient:innen-Rekrutierung, da diese durch die gute medizinische Basisversorgung oft wenig persönlichen Nutzen in einer Studienteilnahme sehen.
Spielt Österreich in der internationalen klinischen Forschung mit oder verlieren wir den Anschluss?
Österreich ist vor allem in der allergologischen Grundlagenforschung führend. Auch bei der Entwicklung der innovativen tablettenbasierten Allergie-Immuntherapie haben heimische Studienzentren wertvolle klinische Daten geliefert. Dennoch gibt es Raum für Verbesserungen, damit Österreich ein attraktiver Studienstandort bleibt.
Wo sind die Pain-Points der klinischen Forschung in Österreich?
Das Clinical Trials Information System der EMA als einziger Einreichkanal für multizentrische Studien bringt aktuell große Umwälzungen. Trotz großer Vorteile bleiben bürokratische Hürden, zudem steigt der Arbeitsaufwand für Studienärzt:innen. Das wiederum erschwert Zentren ohne Studienkoordinator:in eine Teilnahme an klinischen Studien.
Was würden Sie benennen, wenn Sie drei Wünsche zur Verbesserung der Lage freihätten?
Studienkoordinator:innen, die teilnehmenden Ärzt:innen den Rücken für die Arbeit an den Patient:innen freihalten, sind nur in wenigen Zentren verfügbar. Daher braucht es mehr dieser Leute. Weiters sollten bürokratische Hürden abgebaut und der Zeitdruck durch sehr enge Timelines verringert werden. Leider ist die Evidenzlage zu Präparaten zur allergenspezifischen Immuntherapie in Österreich sehr heterogen, so dass Allergiker:innen zum Teil mit Präparaten behandelt werden, deren Wirksamkeit noch gar nicht bewiesen ist. Mein Wunsch wäre es, dass hier die Zulassungsbehörden stärker eingreifen würden, um diesen Zustand zu beheben. Hierfür ist sicherlich die gute Qualität der Österreichischen Studienzentren hilfreich.
Eike Wüstenberg ist Vice President Medical Affairs, ALK Central Europe and International Markets. Neben seiner Unternehmensposition hält der Mediziner eine Professur an der Medizinischen Universität Dresden und ist dabei auf Mittelohr- und Nasenchirurgie sowie Allergologie spezialisiert.
Kampagne
„Wir sagen danke.“
Vier Patient:innen sagen Danke für Therapien, die ihnen ein Leben mit schweren Erkrankungen möglich machen. Mit Krebs, mit Diabetes, mit Multipler Sklerose, mit Spinaler Muskelatrophie. Sehen Sie selbst! Ihre Geschichte und die Hintergründe der Kampagne für lebensverändernde Therapien sind hier nachzulesen: https://bit.ly/Danke-Website

